Apostila preparatória para o concurso da prefeitura municipal do Natal
Ao
se analisar as propriedades dos elementos químicos, nota-se que elas
desaparecem e depois voltam a aparecer. Por isso são ditas periódicas. A
massa atômica, contudo, é uma propriedade APERIÓDICA.
As
propriedades periódicas são importantes porque permitem prever as
propriedades dos elementos de uma mesma família. Além disso, elas se
enquadram na lei periódica, descrita abaixo:
Quando elementos são listados sequencialmente, em ordem crescente de número atômico, é observado uma repetição periódica em suas propriedades.
As principais propriedades periódicas são: raio atômico, potencial de ionização ou energia de ionização e eletronegatividade.
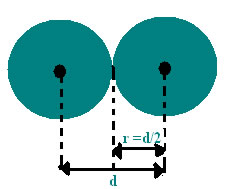
Raio atômico
Por
complexidades extremas para se estimar o tamanho de um átomo,
convencionou-se que raio atômico é a metade da distância mínima
interatômica, isto é, a metade da distância entre os centros de dois
átomos.
Esquematicamente, pode-se representar o sentido de crescimento dos raios atômicos:
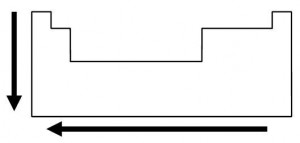
Nos
grupos, os raios atômicos aumentam de cima para baixo. Nos períodos, os
raios aumentam da direita para a esquerda. Exemplo: entre os elementos
Lítio (Li) e Potássio (K), qual deles tem maior raio atômico? E entre o
Potássio e o Bromo (Br)?
Resposta: de acordo com as propriedades do raio atômico, o potássio tem maior raio que o lítio por se encontrar mais abaixo na tabela periódica, bem como tem raio maior que o do bromo, por estar mais afastado no sentido de crescimento.
Energia de ionização
A
energia de ionização é definida como a energia necessária para remover
um elétron de um átomo isolado no seu estado fundamental. Como outros
elétrons podem ser retirados do átomo, a energia para se retirar uma
segunda cara é maior que a primeira, e assim sucessivamente. Observe o
esquema:
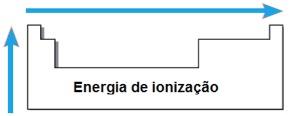
Diferentemente
do raio atômico, nos grupos, a energia de ionização aumenta de baixo
para cima e, nos períodos, da esquerda para a direita. Assim, o Lítio
tem energia de potencial maior que o potássio, e o bromo tem energia de
ionização maior que a do lítio e também do potássio.
Eletronegatividade
Ela é definida como a tendência de um átomo a atrair elétrons. Essa propriedade não leva em consideração os GASES NOBRES, dado que, como já explicados, eles são inertes, isto é, dificilmente doam ou recebem elétrons e reagem com outros elementos.
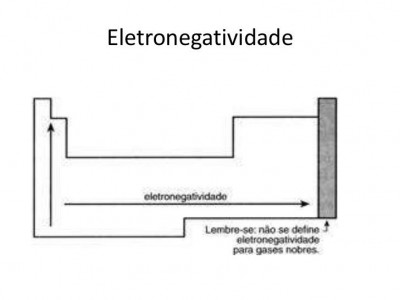
A
eletronegatividade é muito importante para o estudo das ligações
químicas. Seguindo-se o mesmo exemplo, o lítio é mais eletronegativo que
o potássio. O bromo, por sua vez, é mais eletronegativo que o lítio e o
potássio.
Existem outras propriedades periódicas, como a
densidade, a eletropositividade, o volume atômico etc., contudo, são
menos frequentes no Enem e em outros vestibulares. Para quem se
interessa, recomendados que as busquem em materiais de química do ensino
médio.
É isso. Até a próxima!
O post Conheça as Propriedades Periódicas dos Elementos Químicos apareceu primeiro no infoEnem.
Apostila preparatória para o concurso da prefeitura municipal do Natal











.jpg)

![[2^24 + 2^30]/65 = x^x](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEgDK0elX3csGKExdHvk67b1Q-I81hW4kQDloEJ6Z6g5HhUzYzLg8gybPtqIEwsIHEC2Z3paYRXuRyfaR3sL_EhVE2HAPAHy28-0QClNe8M0ShpLM0ixm-BRK5sqm-kbnJDAUeqHE9sfNEYP3Y7UbCZ87CtsZ0adG5yAc5kwxCo3LnJCDr33oM98C-XUV4d2/w100/Blog%20do%20Professor%20Janildo%20-%20Copia.png)






















0 Comentários